
对于溃疡性肠炎(ulcerative colitis,UC)患者而言,慢性炎症反应往往伴随着周期性的组织损伤与修复过程,并最终导致肠癌的发生。
然而,在「损伤 - 修复」的循环过程中,组织内部的细胞构成发生了怎样的变化,这些变化又是如何导致癌症的发生,目前并没有明确的答案。
今天在线发表于 Nature 杂志上的两篇文章从不同角度出发,分析了溃疡性结肠炎患者在从慢性炎症向癌症发展的不同阶段肠道组织内部细胞突变以及组织重塑的特征,进而揭示了在肠炎以及肠癌发展过程中具有关键影响的基因。
研究背景
「体细胞进化」(somatic evolution)特指癌症发生与发展过程中体细胞突变数量不断增多,突变程度不断累积的过程 1。
我们知道,人体内的大多数组织会通过不断自我更新以维持「稳态平衡」。在自我更新的过程中,体细胞「不可避免地」会产生基因突变 2。
近年来,测序技术的突破使得我们能够在单细胞水平鉴定出正常组织中的基因突变类型。
然而值得注意的是,这些产生突变的基因与「驱动肿瘤产生」的基因存在很高的相似性。
遗传学研究也证明,体细胞演化使得细胞产生了「自发性自我更新」的能力,从而有助于肿瘤的产生。这些结果强调了体细胞进化在癌症发生过程中的重要性。
借鉴达尔文的「自然选择学说」,体细胞突变可能同时会受到周围环境的影响,然而这一假设目前并没有实验证据证实。
主要内容
1. 炎症环境对肠上皮细胞「定向演化」的影响
在题为《Somatic inflammatory gene mutations in human ulcerative colitis epithelium》的研究中,来自日本庆应义塾大学医学院的 Toshiro Sato 教授团队分析了慢性炎症环境对肠道上皮细胞突变的影响 3。
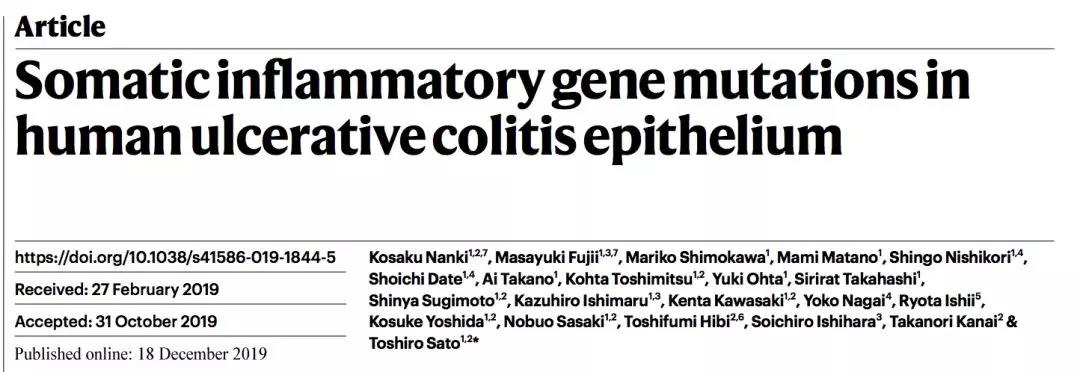
首先,作者分别从健康群体(HC),非癌性 UC 患者(UC without CAN)以及癌性 UC 患者(UC with CAN)体内采集了肠道组织。
下图描述了样本的采集思路。
具体而言,所有健康患者来源的组织均被认为是健康对照;非癌性 UC 患者来源的组织可以进一步分为非炎性组织(绿色)以及炎性组织(红色);来源于癌性 UC 患者的组织进一步分为肺炎性组织(绿色)炎性组织(黑色)以及癌化组织(紫色)。
样本的采集思路
图片来源:Nature
为了在单细胞水平得到与炎症环境有关的体细胞突变的信息,作者利用上述收集得到的样本建立了基于单细胞克隆的体外类器官培养体系,并进行了外显子测序分析。
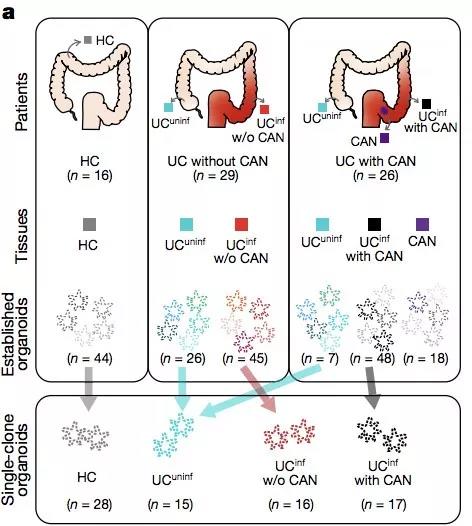
由下图可知,在健康对照中,随着年龄的增长会缓慢地出现并积累单核苷酸突变(SNV)事件(0.019 次 / Mb / 年),这一结果与此前研究相符。
进一步,作者分析了在疾病进展过程中不同组织部位的突变频率。
结果表明,相对于健康人群对照(灰色)以及患者的健康组织对照(蓝色),患病组织的突变频率随疾病发展有显著的升高(红色,黑色)。
这一结果反映了炎症环境与细胞突变之间存在相关性。
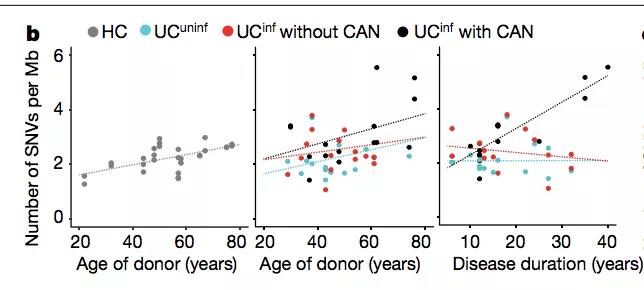
为了避免因患者个体差异对结果产生的影响,作者挑选了部分患者来源的样本进行了内部配对分析,即用于两两比对的样本均来自于同一患者,仅采集部位有所差异。
结果表明,不同于正常群体,患者来源的炎性组织比非炎性组织具有更高的突变几率。这一结果进一步肯定了肠道炎性环境与细胞突变之间的关联。
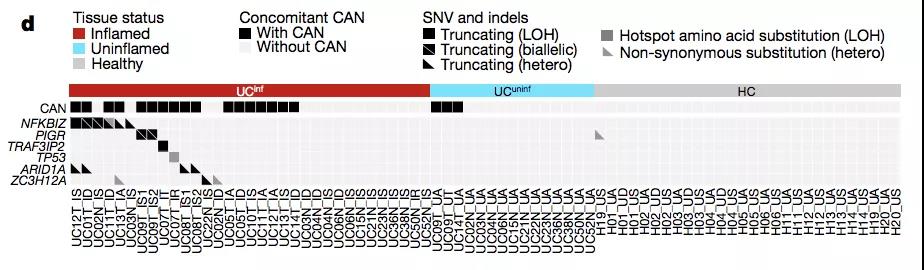
过对测序结果进行更进一步的分析,作者发现:来源于炎性组织的类器官中存在免疫相关基因 —— NFKBIZ、PIGR 和 TRAF3IP2 等的累积突变,其中包括单核苷酸突变以及缺失突变。
对于单核苷酸突变而言,上述两类基因发生「错义突变」的几率远远高于「同义突变」。
此外,由于上述突变在染色体的两个拷贝中都有发生,意味着基因组稳定性有所下降。
之后,作者针对上述突变产生的生物学效应展开了研究。
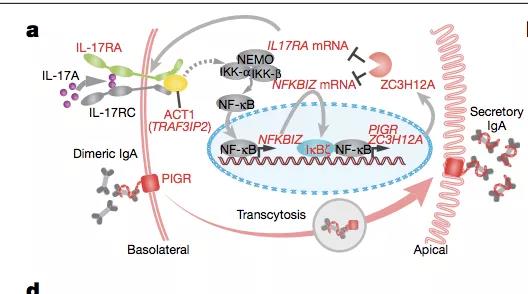
此前研究表明 NFKBIZ 负责编码 IκBζ,后者受 NF-KB 信号影响而上调,并进一步促进 NF-KB 的持续活化,形成正反馈调节。
PIGR 编码一种表达于细胞表面的分子,调节转胞吞作用(transcytosis)和二聚体 IgA 的分泌。
TRAF3IP2(也称为 ACT1)是 IL-17 受体的下游衔接蛋白,对于激活 NF-κB 信号至关重要。因此,上述突变可能影响了 IL-17 介导的 NF-KB 活化的过程。
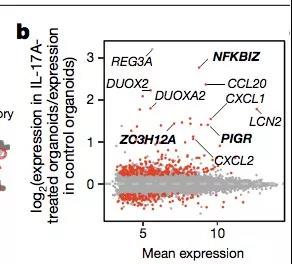
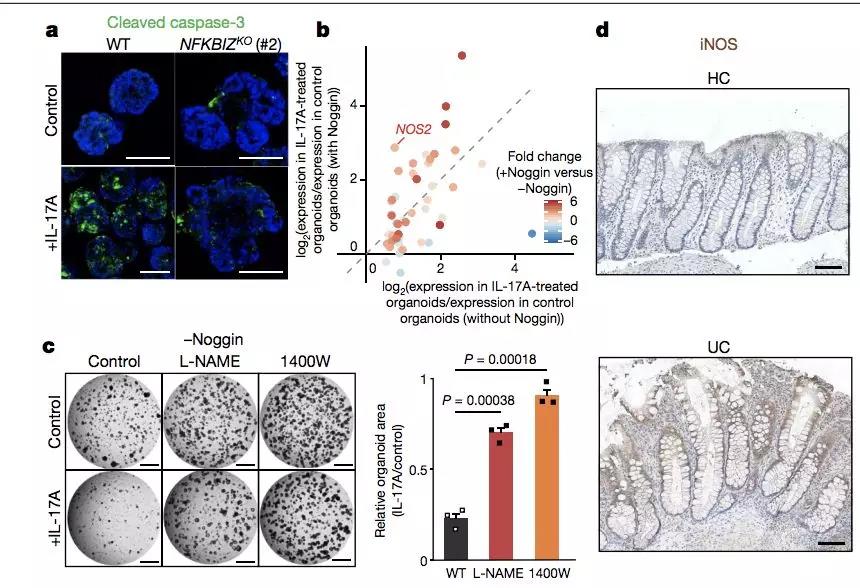
为了验证这一假设,作者比较了健康组织来源的类器官在 IL-17A 刺激下上述基因的表达情况。
结果表明,健康情况下上述基因在受到 IL-17A 刺激后会显著提高其表达量。
上述结果表明,肠道细胞发生 IL-17 信号通路相关的「体细胞演化」可能与肠道炎症环境带来的「选择压力」有关。
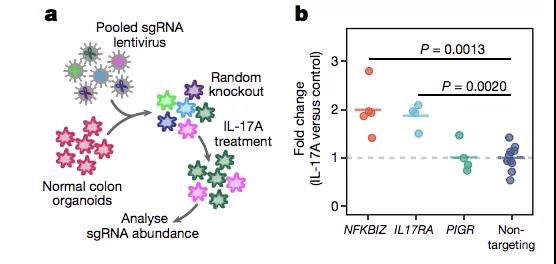
为了验证这一猜想,作者利用 CRISPR-CAS9 技术人为地敲除了健康组织来源的类器官中特定基因的活性。
通过 IL-17 刺激,作者发现:在敲除了 NF-KBIZ 或者 IL17RA 之后,在 IL-17 刺激下类器官发生了明显的增殖。这表明类器官的定向演化有利于其在炎症环境中生存。
然而 PIGR 突变则没有相应的效果,表明 PIGR 的作用可能牵涉到下游包括 IgA 的活性在内的复杂机制,有待于进一步的研究。
上述结果表明,肠道细胞发生 IL-17 信号通路相关的「体细胞演化」可能与肠道炎症环境带来的「选择压力」有关。
为了验证这一猜想,作者利用 CRISPR-CAS9 技术人为地敲除了健康组织来源的类器官中特定基因的活性。
通过 IL-17 刺激,作者发现:在敲除了 NF-KBIZ 或者 IL17RA 之后,在 IL-17 刺激下类器官发生了明显的增殖。这表明类器官的定向演化有利于其在炎症环境中生存。
然而 PIGR 突变则没有相应的效果,表明 PIGR 的作用可能牵涉到下游包括 IgA 的活性在内的复杂机制,有待于进一步的研究。
2. 肠上皮细胞关键基因突变调控肠炎向肠癌的转变

在另外一篇名为《Frequent mutations that converge on the NFKBIZ pathway in ulcerative colitis》的研究中,来自京都大学的 Seishi Ogawa 团队同样以肠炎为研究对象,揭示了关键基因的突变如何影响肠炎向肠癌的转化 4。
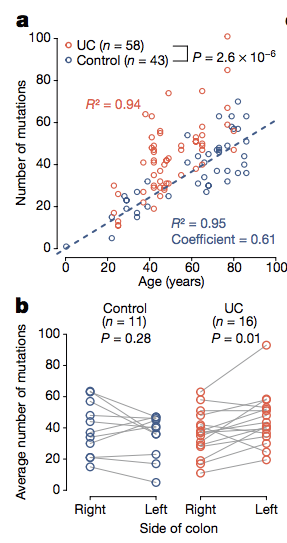
首先,作者对来源于健康人以及肠炎患者的肠道隐窝组织(Crypt)进行外显子测序分析,发现相比于健康对照,肠炎患者在同样时间内发生基因突变的几率明显更高。
同样地,作者通过对测序结果进行分析,发现肠炎患者隐窝组织中三类基因(NFKBIZ, PIGR 以及 ARID1A)的突变程度存在显著差异。
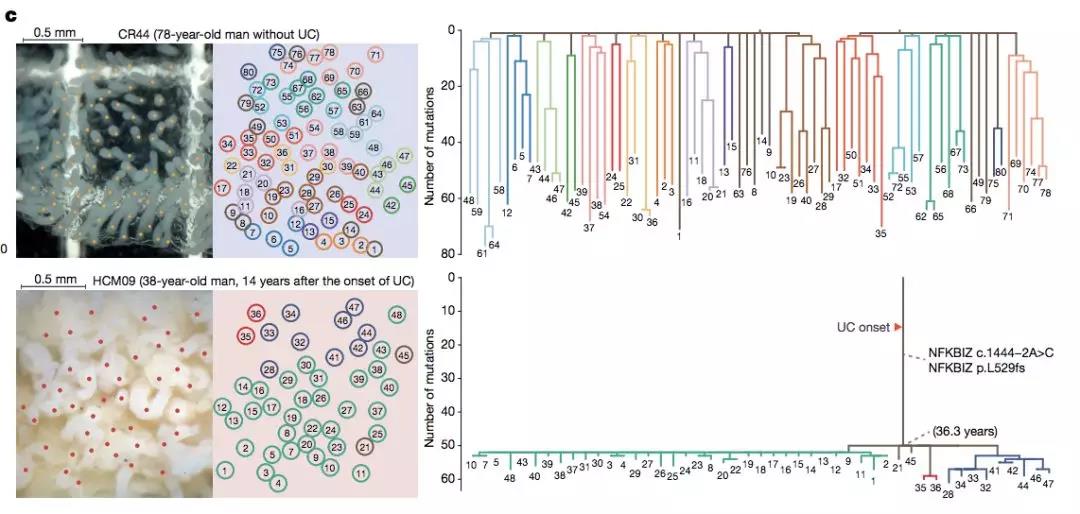
接下来,作者对隐窝组织的扩张历程进行了追踪分析。
通过外显子测序对不同部位的隐窝序列相似性进行比对,描绘出了它们之间的继承关系以及空间关系。
结果表明:正常人隐窝组织的分化与扩张在 20 岁时就已经完成,之后长期处于较为稳定的状态。
相比之下,肠炎患者的隐窝组织则经历了由特定基因突变主导的重复性的破坏与重建过程,进而导致大部分突变后的隐窝组织存在相同的,且时间间隔很近的前代细胞。
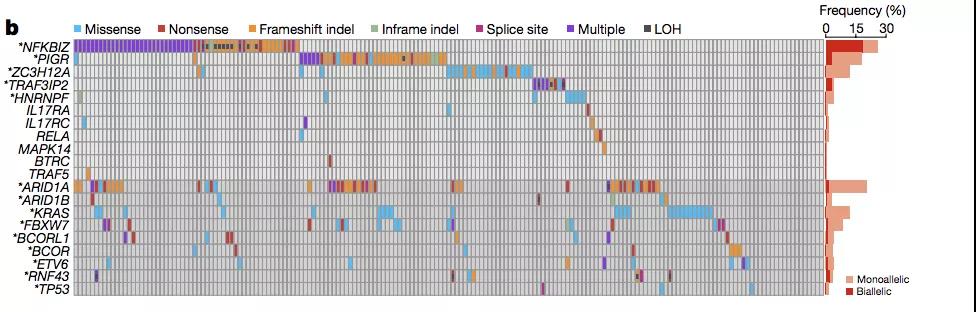
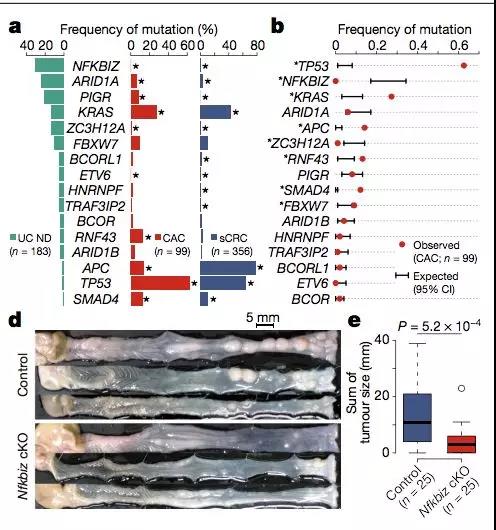
为了进一步揭示肠道上皮细胞的「定向演化」背后的机制,作者分析了从 399 个非癌性肠炎样本中检测得到了 30000 多个突变,并鉴定得到了 14 个对于「定向演化」具有重要作用的驱动基因。
其中出现频率最高的依次为:NFKBIZ,ARID1A,PIGR,KRAS 以及 ZC3H12A 等。
另外很重要的一点是,这些突变基因中的大部分都与 NFKBIZ 以及 IL-17 信号有关。因此,作者认为上述基因突变驱动的肠上皮细胞定向演化可能与 IL-17 信号具有内在的联系。
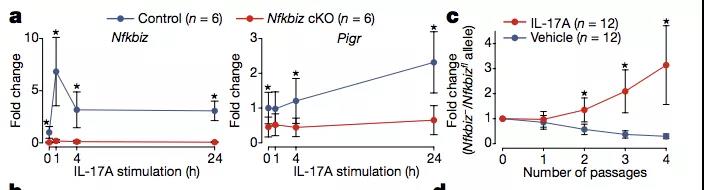
为了验证这一猜想,作者同样采用了类器官培养的手段。通过比较野生型以及 NFKBIZ 缺失突变型小鼠肠道类器官。
作者发现:在 IL-17A 刺激下,野生型小鼠肠道组织 NF-KBIZ 以及 PIGR 基因的表达水平显著高于突变体。此外,在受到 IL-17A 刺激下,突变体小鼠来源的类器官生长速率明显高于野生型。
这一结果表明 NF-KBIZ 即相关基因突变能够使得肠上皮细胞在 IL-17A 环境下更好的生长。
最后,作者研究了 NFKBIZ 突变对肠癌发生的影响。
结果表明,NFKBIZ 以及相关基因突变虽然在肠炎样本中较为丰富,但在肠癌组织中则突变率很低;此外,在 NFKBIZ 缺失突变的小鼠中,肿瘤的发生率以及严重程度都有明显下降。
上述结果表明 NFKBIZ 突变有助于抑制肠炎向肠癌的发展。
拓展阅读
Seishi Ogawa 教授长期致力于癌症遗传学方面的研究,在该领域具有十分重要的影响力。早在 2014 年,Ogawa 教授曾在 Science 杂志发文,揭示了库氏综合征(Cushing’s syndrome)背后的体细胞突变机制,为治疗这一种内分泌紊乱疾病提供了新的思路 5。
总结与讨论
本文两项研究为我们揭示了肠炎与肠上皮细胞定向突变之间复杂的关系。
其中,Toshiro Sato 教授通过体外培养人类患者的类器官并进行高通量的外显子测序分析,揭示了肠道炎症环境对肠上皮细胞突变的影响,并从「自然选择」的角度解释了这种定向突变为何有助于肠上皮细胞的生存。
Seishi Ogawa 教授等人则通过对人类样本进行分析,揭示了肠炎患者体内肠上皮细胞高频突变的现象以及突变细胞「同质化」的内在原因。
此外,作者通过外显子测序以及小鼠遗传模型确定了肠炎组织中参与肠上皮细胞定向演化的关键基因,并证明了这些基因突变对于抑制肠癌发生的作用。
细胞的癌变往往由于基因突变的不断累积而造成的,而炎性刺激则是众多导致基因突变的原因之一。
通过最近的两项研究,我们了解了慢性炎症对肠道组织的破坏以及细胞发生基因突变的内在机制,并且将研究目光精确到了特定的若干基因。
然而,上述基因突变在如何抑制癌症的发生目前并没有明确的答案。对此还需要进一步的探索。
类器官培养是基础与转化医学领域新型的一类研究手段。相比于传统的动物模型,这一方法对于研究临床样本具有明显的优势。
上述研究提供了很好的类器官培养技术应用的实例,随着技术的发展,我们希望能够进一步提高类器官的使用效率以及应用范围。